Genexpressionsanalyse von Makrophagen: Folgerungen für eine immunsuppressive Wirkung von dissoluzytotischen GoldionenAls Hintergrund weisen die Autoren darauf hin, dass das „Edel“metall Gold seit langem als Medizin verwendet wird. Goldsalze wurden zur Behandlung von rheumatoider Arthritis (RA) eingesetzt, das Ansprechen auf sie ist allerdings unvorhersagbar und sie haben Nebenwirkungen, sodass sie durch Biologicals wie TNF-
Makrophagen exprimieren [Zell]Adhäsionsmoleküle, Chemokinrezeptoren und andere Oberflächenantigene und sekretieren eine Anzahl von Chemokinen, Zytokinen, Wachstumsfaktoren, Proteasen und anderen Mediatoren. Makrophagen und ihre Produkte sind Hauptakteure bei der Pathogenese der RA und anderer entzündlicher Erkrankungen und können vielversprechende therapeutische Ziele sein. Mittels Autometallographie (AMG) wurde die Bewegung von Goldionen aus der Dissolutionsmembran in die interzelluläre Umgebung beobachtet, von wo sie in Makrophagen, Mast- und andere Zellen eintreten. Es wurde „festgestellt, dass eine Ionisierung schneller in entzündlichem als in normalem Gewebe auftritt und dass, je größer die Oberfläche ist, umso größer auch die Ionisierung des Goldes ist“. Ziel der Autoren war die Untersuchung, ob durch das Wachsen humaner Makrophagen der Zelllinie TCP-1 auf 24-karätigen Goldfolien Goldionen freigesetzt und von den Zellen aufgenommen werden und ob dieser Vorgang verbunden ist mit Änderungen in der Genexpression und nachfolgenden Proteinsekretion und in der Zellviabilität. Dazu haben die Autoren TCP-1-Zellen kultiviert und auf kleinen Goldfolien wachsen lassen. Nach 1, 2, 3 und 4 Tagen wurden sie geerntet und die intrazelluläre Gold-Aufnahme mittels Autometallographie (AMG) analysiert. Dazu wurden sie auf Objektträger gebracht, mit UVA-Bestrahlung wurde das Gold durch Ionisierung reduziert, mittels AMG silberverstärkt, wobei Silber an Goldnanopartikeln angelagert wird. Der Einfluss phagozytierter Goldionen auf die Zellviabilität wurde mittels Trypanblaufärbung und TUNEL-Methode analysiert. Das globale Genexpressionsprofil der THP-1-Zellen nach Goldaufnahme wurde untersucht. Dazu wurde RNA gesammelt und kontrolliert, einer Cy3-Markierung unterzogen, hybridisiert und gescant. Expressionswerte wurden berechnet und statistisch untersucht. Signifikant exprimierte Gene (ANOVA, p < 0,05) mit einem Fold change
Ergebnisse: Die AMG zeigte eine verstärkte intrazelluläre Aufnahme von Goldionen (Dissoluzytose) in kultivierten THP-1-Zellen nach 4 Tagen, jedoch keine signifikante Aufnahme nach 1, 2 oder 3 Tagen. Keine signifikante Wirkung auf die Viabilität der THP-1-Zellen wurde gefunden: Die Zellviabilität lag mit und ohne Gold bei > 95 % nach Trypan-Methode, und 14,1 % bzw. 13,2 % der Zellen waren TUNEL-Test-positiv. Das legt nahe, dass die antientzündliche Wirkung möglicherweise nicht durch den Zelltod von Makrophagen vermittelt wird. Die Daten zeigten eine einzigartige Genexpressionssignatur dissoluzytotischer THP1-Zellen, die Goldionen aufgenommen hatten (von 20.000 untersuchten Genen waren 1028 (fold change (FC)
Die Untersuchungsergebnisse dieser Studie gewähren neue Einblicke in den Wirkmechanismus von Goldionen und legen die Untersuchung der Wirkung auf andere entscheidende Zellen (z. B. T- und B-Lymphozyten) und eine mögliche künftige Rolle metallischer Goldimplantate bei der rheumatoiden Arthritis oder anderen entzündlichen Erkrankungen nahe.
|


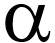 -Hemmer ersetzt wurden. Metallische Goldimplantate werden auch seit langem in der Tiermedizin verwendet. Freigesetzte Goldionen haben sich als antientzündlich erwiesen. Der Wirkmechanismus wird noch nicht voll verstanden. Es wurde gezeigt, dass Goldionen die lysosomalen Enzyme phagozytotischer Zellen hemmen, die Zahl der Makrophagen in der Synovialmembran verringern und die Produktion proinflammatorischer Zytokine in Zellkulturen herabsetzen. Danscher zeigte als Erster, dass aus reinen metallischen Goldimplantaten Goldionen freigesetzt werden. Sein Team zeigte, dass sich Makrophagen auf die Biomembran richten, die metallische Goldimplantate bedeckt. „Goldionen werden unter dem Einfluss der anhaftenden Makrophagen aus der metallischen Goldoberfläche in die ,Dissolutionsmembran‘ freigesetzt.“
-Hemmer ersetzt wurden. Metallische Goldimplantate werden auch seit langem in der Tiermedizin verwendet. Freigesetzte Goldionen haben sich als antientzündlich erwiesen. Der Wirkmechanismus wird noch nicht voll verstanden. Es wurde gezeigt, dass Goldionen die lysosomalen Enzyme phagozytotischer Zellen hemmen, die Zahl der Makrophagen in der Synovialmembran verringern und die Produktion proinflammatorischer Zytokine in Zellkulturen herabsetzen. Danscher zeigte als Erster, dass aus reinen metallischen Goldimplantaten Goldionen freigesetzt werden. Sein Team zeigte, dass sich Makrophagen auf die Biomembran richten, die metallische Goldimplantate bedeckt. „Goldionen werden unter dem Einfluss der anhaftenden Makrophagen aus der metallischen Goldoberfläche in die ,Dissolutionsmembran‘ freigesetzt.“ 2 wurden als differenziell reguliert betrachtet. Die Genexpressionsdaten wurden durch Messung sekretierter Proteine bestätigt. Gemessen wurden early growth response 1 (EGR1), fatty acid desaturase 1 (FADS1) und Lymphotoxin B (LTB). Die Ergebnisse der Datenanalyse wurden als Mittelwert ± Standardabweichung ausgedrückt, Unterschiede zwischen Gruppen [ohne/mit Gold] mit Student-t-Test analysiert, und Werte p < 0,05 wurden als signifikant betrachtet.
2 wurden als differenziell reguliert betrachtet. Die Genexpressionsdaten wurden durch Messung sekretierter Proteine bestätigt. Gemessen wurden early growth response 1 (EGR1), fatty acid desaturase 1 (FADS1) und Lymphotoxin B (LTB). Die Ergebnisse der Datenanalyse wurden als Mittelwert ± Standardabweichung ausgedrückt, Unterschiede zwischen Gruppen [ohne/mit Gold] mit Student-t-Test analysiert, und Werte p < 0,05 wurden als signifikant betrachtet.